Cyclo-heptasulfur, S7-Um efeito anomérico clássico descoberto durante um almoço de pub!
Em 1977, a estrutura cristalina do anel de enxofre S7 foi relatado. (CITE) 10.1002/anie.197707151 (/cite) Os autores observaram que “A modificação δ de s7 Contém ligações de comprimento amplamente diferente: isso nunca foi observado anteriormente em uma molécula não substituída.“Nenhuma explicação foi oferecida, embora eles observem que efeitos semelhantes foram observados em S8O, s7EU+ e s7O. os s7 Molecule foi ontem trazido à minha atenção (graças a Derek!) Durante um almoço de pub e, na maneira de honrar os cientistas, esboçaram -se em um guardanapo (com uma caneta obtida da garçonete!). Como um “químico orgânico”, pensei imediatamente “efeitos anoméricos”. E assim, de fato, provou. Um cálculo usando o método e análise MN15L/DEF2-TZVPP DFT usando o procedimento WeinHold NBO7 (CITE) 10.14469/HPC/15223 (/cite) revela a seguinte estrutura (com simetria de CS) e, de fato, as quatro distâncias SS exclusivas são diferentes (valores experimentais nos parânticos). Então, como isso surge?
Efeito 1 é a doação de um par solitário do enxofre S4 ou S2 para o orbital antibonding da ligação S3-S7 longa marcada 2.174å (a energia da perturbação da NBO E (2) é de 12,35 kcal/mol, um efeito bastante grande quando você considera que o valor mais convencional que envolve oxigênio em vez de sulfur é ~ 16 kcal Kcal. Existem duas dessas doações (pretas e vermelhas) e, portanto, esse vínculo longo é duplamente prolongado. Simultaneamente, as ligações S4-S7 ou S2-S3 associadas ao enxofre doador são reduzidas (1.982å).
Você pode ver os orbitais envolvidos abaixo (clique na imagem para obter um modelo rotativo 3D) e considerar que a fase azul se sobrepõe positivamente ao roxo e também ao vermelho com laranja. Essas sobreposições conspiram para mover os elétrons do par solitário S4 para a ligação S4-S7 e mover elétrons da ligação S3-S7 para um par solitário S3 e, portanto, reduzir a primeira e alongar a segunda ligação.
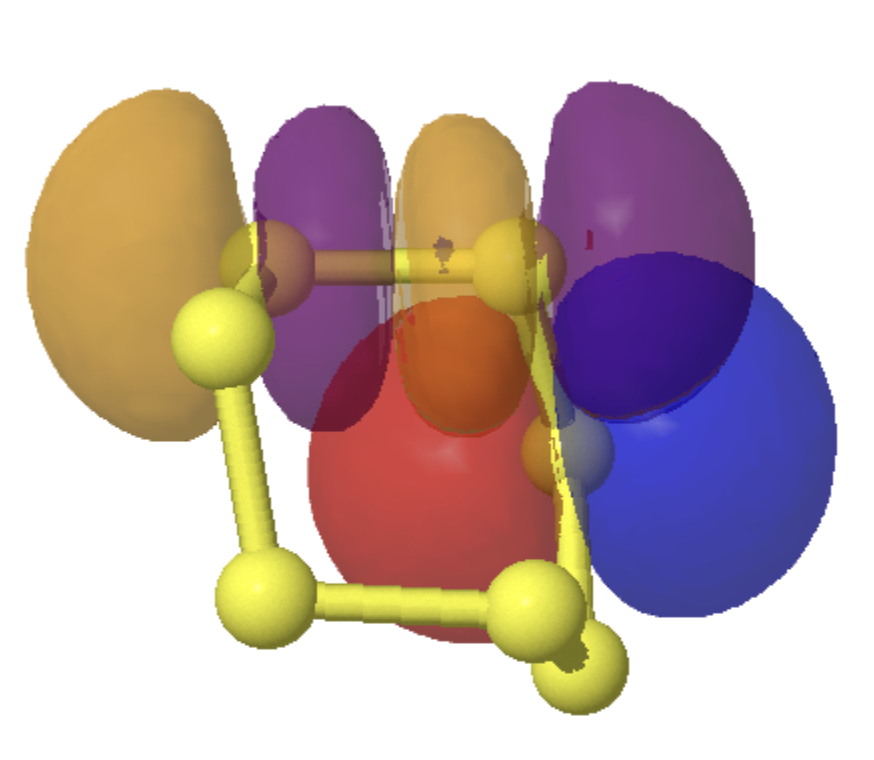
Efeito 2 é a doação de um par solitário do enxofre S3 ou S7 no orbital antibonding da ligação S1-S2 com comprimento 2.087å. Apenas uma doação (E (2) agora é 10,12 kcal/mol) para cada um dos dois orbitais de antibonding SS (S1-S2 e S4-S5) e, portanto, o alongamento deles é menor do que antes. Isso serve novamente para reduzir as ligações S2-S3 e S4-S7 marcadas com a distância de 1,982å
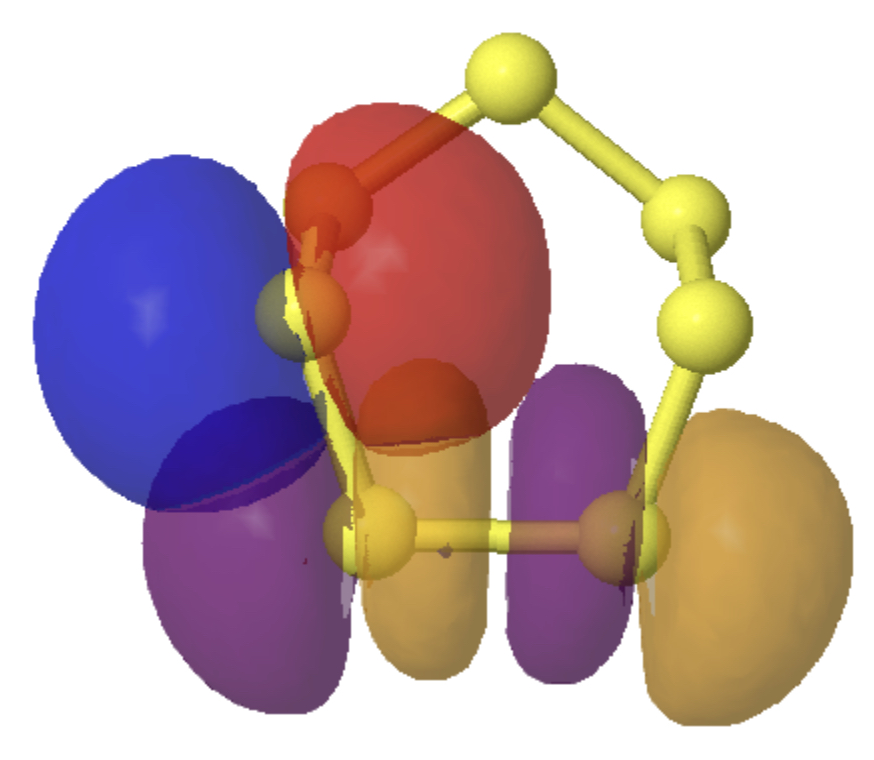
Um efeito menor (E (2) 4,6 kcal/mol) ocorre entre S2/S4 e S1-S6/S5-S6.
Portanto, isso acrescenta uma boa explicação estereoeletrônica a uma observação feita há quase 50 anos. Talvez este exemplo deva ser incluído em todos os currículos inorgânicos ensinados?
PostScript: As frequências de alongamento da SS variam muito. Os modos S2-S3 e S4-S7 simétricos e antissimétricos são respectivamente ν 564 e 557 cm-1 enquanto o modo S3-S7 é muito menor a 370 cm-1
Relacionado
Esta entrada foi publicada na sexta -feira, 16 de maio de 2025 às 15:26 e é arquivada em Química interessante. Você pode seguir qualquer resistência a esta entrada através do RSS 2.0 alimentar. Você pode Deixe uma respostaou trackback do seu próprio website.







