Já escrevi algumas vezes sobre os chamados “efeito anomérico“, que se refere a interações estereoeletrônicas em moléculas como açúcares contendo um átomo de carbono tetraédrico com pelo menos dois substituintes de oxigênio. O efeito pode ser detectado quando os dois comprimentos de ligação CO em tais moléculas são inspecionados, mais obviamente quando uma dessas ligações tem um comprimento muito diferente da outra. O efeito se origina quando um dos pares solitários de elétrons em um átomo de oxigênio se sobrepõe exclusivamente à antiligação CO σ* em outro oxigênio, encurtando assim o comprimento do comprimento doador oxigênio-carbono e aumentando o comprimento da ligação CO aceitante. Aqui eu dou uma olhada nas versões tetra-substituídas deste (C(OR)4), onde em teoria existem até oito pares isolados, interagindo com qualquer uma das três ligações CO, dando um complete de 24 efeitos anoméricos possíveis em uma molécula.
Iniciamos o processo com uma pesquisa no banco de dados de estrutura cristalina de Cambridge, usando a seguinte consulta de pesquisa: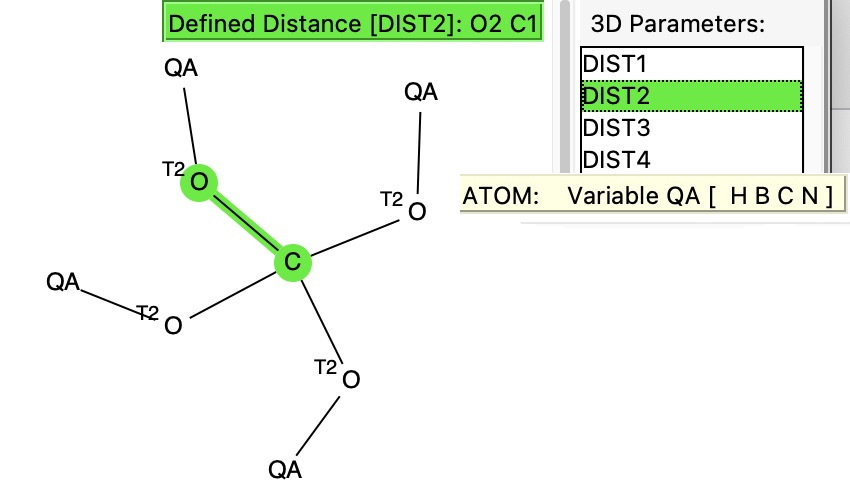
Isso rende 25 acertos. Queremos agora descobrir quais são as ligações CO mais longas e mais curtas e qual é a diferença entre elas. Para isso, temos que recorrer à aplicação de algumas funções, utilizando a ferramenta calculadora integrada no software program de análise Mercury. As seguintes funções foram usadas:
- Maior('pesquisa3'.'DIST1','pesquisa3'.'DIST2','pesquisa3'.'DIST3','pesquisa3'.'DIST4')
- Menos('pesquisa3'.'DIST1','pesquisa3'.'DIST2','pesquisa3'.'DIST3','pesquisa3'.'DIST4')
- Maior('pesquisa3'.'DIST1', 'pesquisa3'.'DIST2', 'pesquisa3'.'DIST3', 'pesquisa3'.'DIST4')-Mínimo('pesquisa3'.'DIST1', 'pesquisa3'.' DIST2', 'pesquisa3'.'DIST3', 'pesquisa3'.'DIST4')

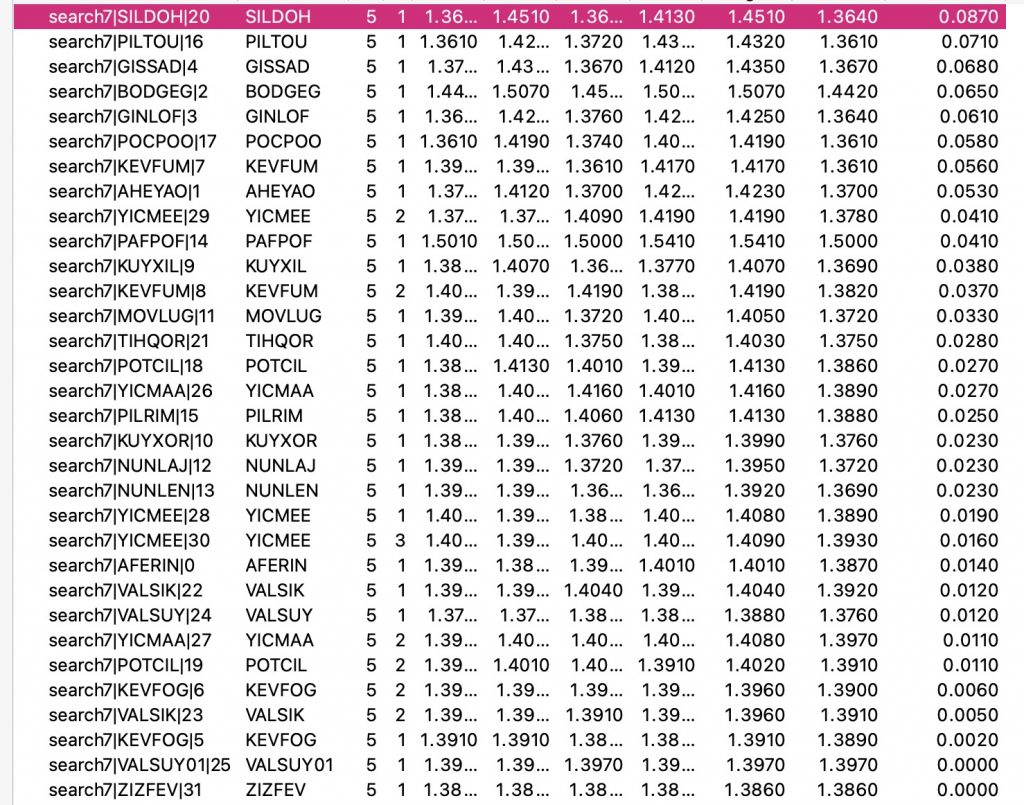
Os resultados podem ser exibidos conforme abaixo, em que a diferença entre os dois comprimentos de ligação é codificada por cores (vermelho = maior, azul = menor).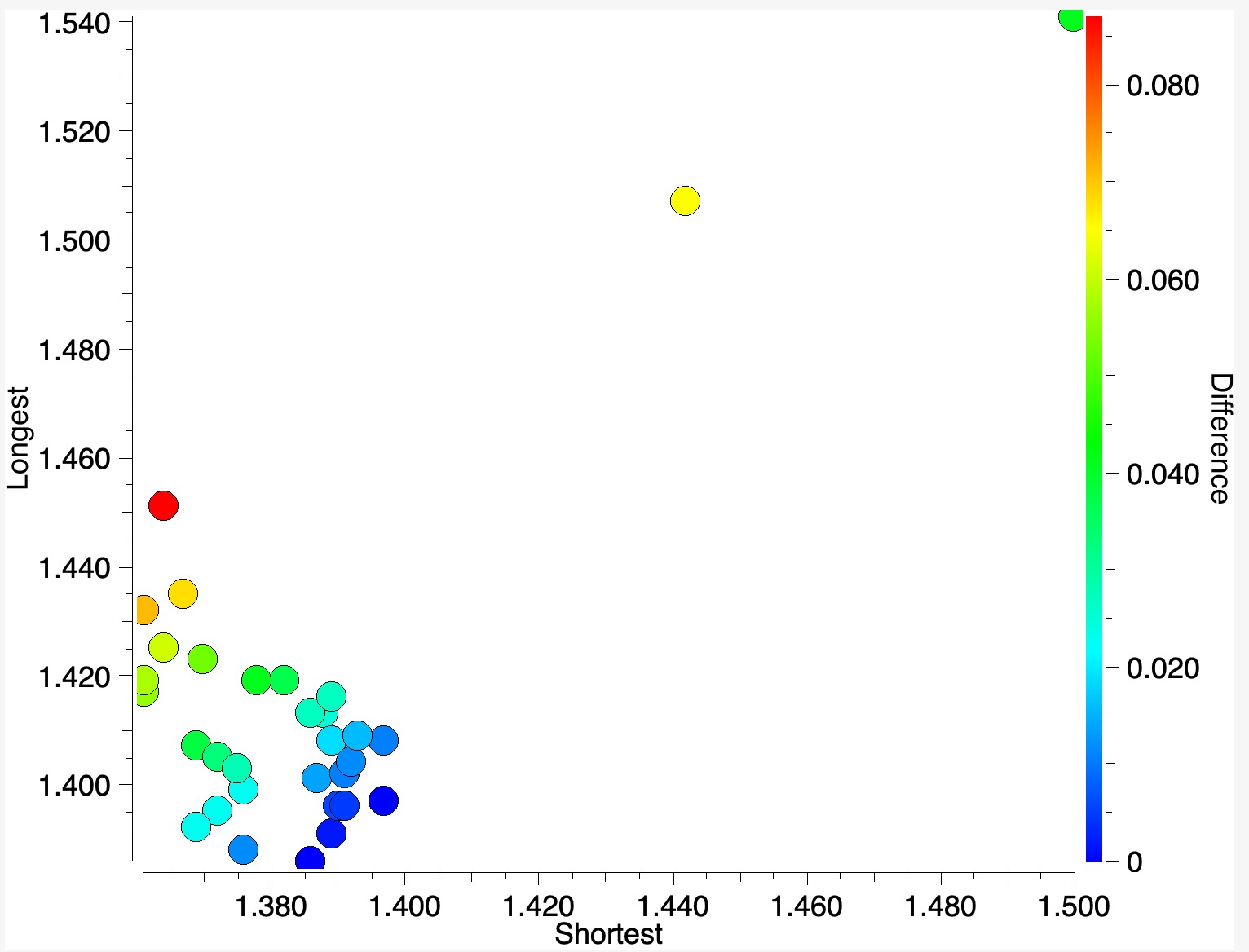
- Aqui você pode ver que quando a diferença entre os comprimentos das ligações CO mais longas e curtas é pequena, a cor é azul.
- Os pontos verdes mostram uma diferença de cerca de 0,04-0,05Å
- O ponto vermelho tem a maior diferença de 0,087Å e corresponde à entrada SILDOH ((cite)10.1107/S1600536807042298(/cite), DataDOI: (cite)10.5517/ccq8lq8(/cite), 10.5517/ccq8lq8.
O próximo passo é aplicar uma “verificação da realidade” usando computação, aqui um cálculo MN15L/Def2-TZVPP nas oito principais entradas classificadas pelas maiores diferenças de comprimento de ligação CO (ΔrCO > 0,05Å.(cite)10.14469/hpc/13925(/cite), dados DOI: 10.14469/hpc/13925
| Código de referência CCDC | Estrutura cristalina | Estrutura computacional | ||||
|---|---|---|---|---|---|---|
| Mais longo | Mais curto | Δ | Mais longo | mais curto | Δ | |
| SILDOH | 1.451 | 1.364 | 0,087 | 1.441 | 1.367 | 0,074 |
| PILTOU | 1.432 | 1.361 | 0,071 | 1.418 | 1.378 | 0,040 |
| GISSAD | 1.435 | 1.367 | 0,068 | 1.422 | 1.375 | 0,047 |
| BODGEG | 1.507 | 1.442 | 0,065 | 1.424 | 1.370 | 0,054 |
| GINLOF | 1.425 | 1.364 | 0,061 | 1.418 | 1.377 | 0,041 |
| POCPOO | 1.419 | 1.361 | 0,058 | 1.421 | 1.371 | 0,050 |
| KEVFUM | 1.417 | 1.361 | 0,056 | 1.395 | 1.391 | 0,004 |
| AHEYAO | 1.423 | 1.370 | 0,053 | 1.422 | 1.372 | 0,050 |
- O maior efeito ocorre para SILDOH, e isto é replicado por cálculo.
- A maior discrepância entre medição e cálculo é para KEVFUM, onde o cálculo não prevê quase nenhuma diferença nas ligações de CO. Isto será discutido em outro lugar.
Focando no SILDOH, olhamos para as energias NBO E(2) para as interações doador-aceitador de um par solitário de oxigênio doando para um CO antiligante σ* orbital.
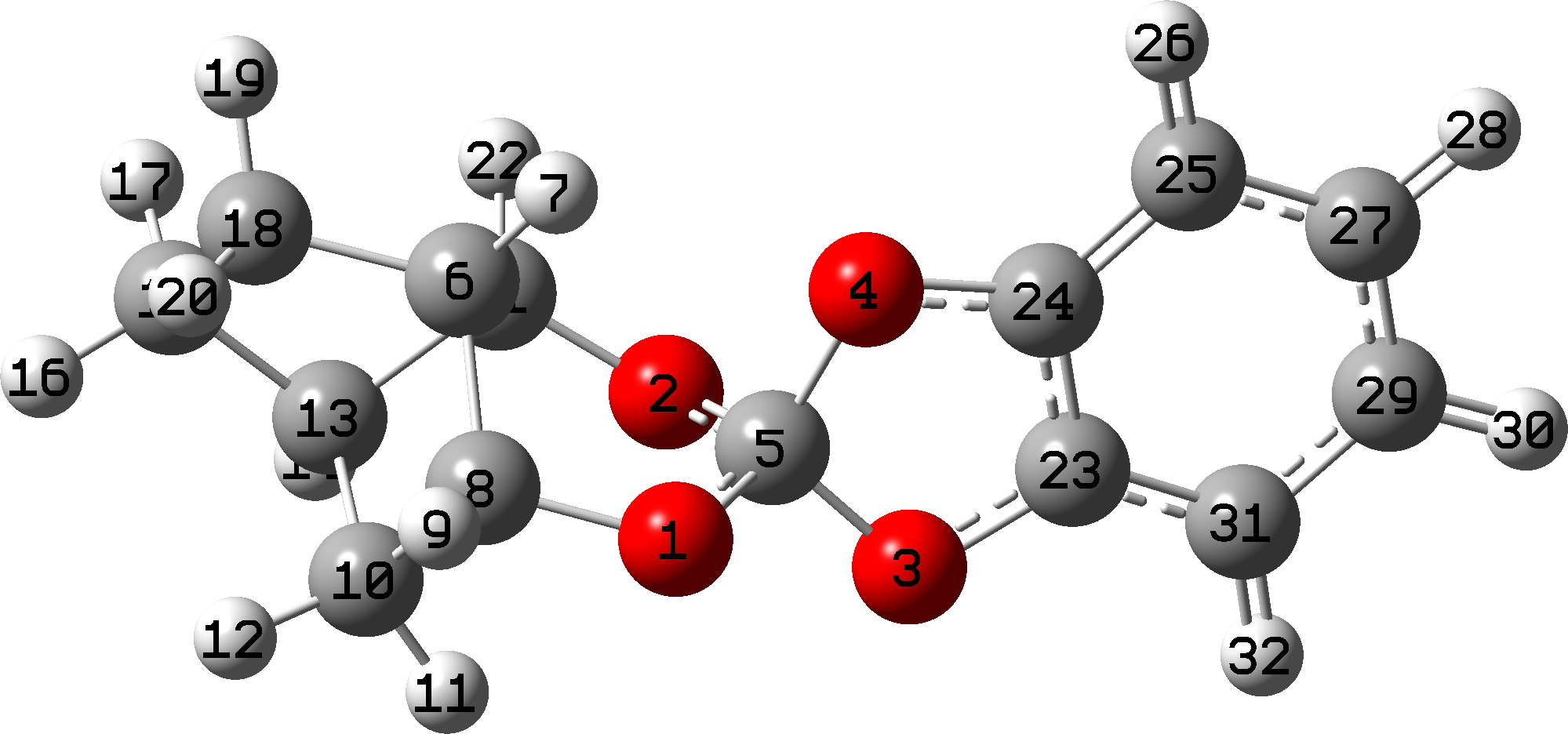
Clique na imagem abaixo para ver um modelo 3D dos dois orbitais em interação (sobreposição positiva = azul + roxo, vermelho + laranja)
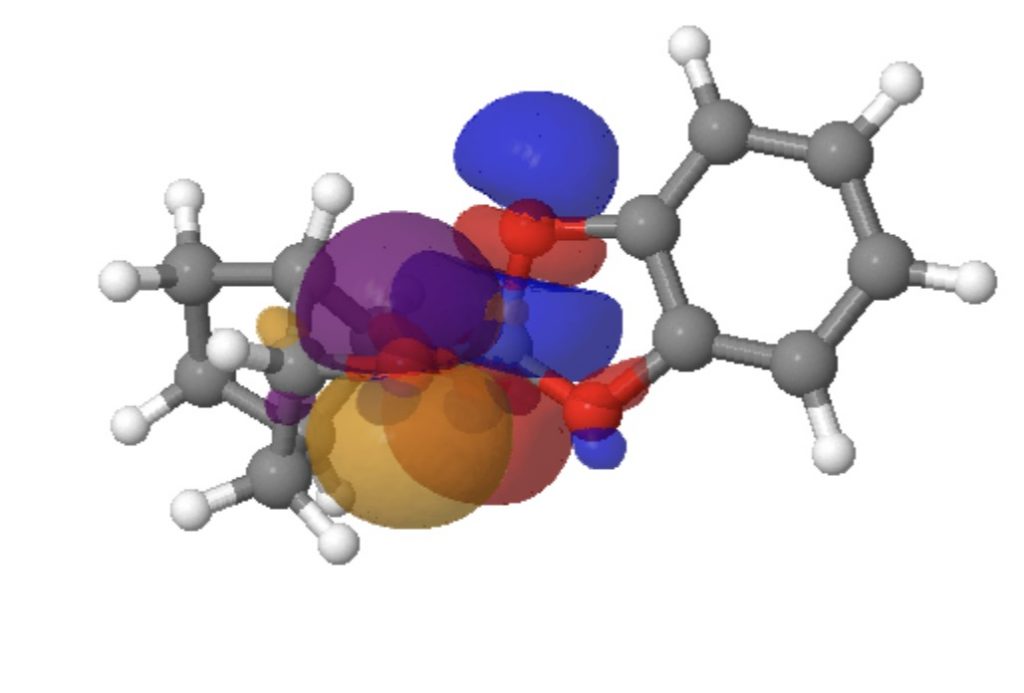
A interação de LpO1 com a ligação longa C5-O4 = 18,0 e LpO2 a C5-O4 = 16.3 kcal/mol, enquanto na direção inversa, LpO4 para C5-O1 é apenas 6,0 kcal/mol e LpO4 para C5-O2 é 10.7 calorias/mol. Para uma ligação CO “regular”, como C5-O3, LpO2 a C5-O3 = 3.1 e LPO1 a C5-O3 = 5.3 calorias/mol. Com efeito, dois oxigênios “se unem” para enfraquecer a longa ligação C5-O4, mas deixam a ligação C5-O3 mais curta em paz. Portanto, os efeitos anoméricos individuais não são maiores que o regular, mas o efeito cooperativo de dois agindo juntos é o que produz a assimetria geométrica last.
O índice de obrigações Wiberg reflecte este efeito. Os índices de títulos são 0,9882 para O1-C5 e C5-O4 0,8512 (Δ =-0,137), o que é uma grande diferença na ordem dos títulos e é responsável pela grande diferença (recorde?) No comprimento dos títulos.
No próximo publish analisarei as moléculas equivalentes B(OR)4–.
Relacionado
Etiquetas: Química interessante
Esta entrada foi publicada segunda-feira, 18 de março de 2024 às 16h52 e arquivada em Sem categoria. Você pode acompanhar quaisquer respostas a esta entrada através do RSS 2.0 alimentar. Você pode deixe uma respostaou trackback do seu próprio web site.






