Explorando o metanotriol – “a formação de uma molécula impossível”
O que constitui uma “molécula impossível”? Bem, aqui estão dois, sendo o primeiro o tema de um artigo recente(cite)10.1021/jacs.4c02637(/cite). A segunda é a favorita dos professores de química orgânica, para ver se seus alunos a reconhecem como uma forma incomum (= impossível) de uma molécula muito mais conhecida.
Talvez pudéssemos definir moléculas impossíveis em duas courses ligeiramente diferentes.
- A primeira classe é uma molécula que é inteiramente regular em termos de sua estrutura e ligação, mas é termodinamicamente menos estável do que uma forma isomérica. Se todas as possibilidades mecanicistas para convertê-lo para a forma mais estável forem eliminadas, então não há razão para que não seja detectado, mesmo que seja “impossível”. A propósito, um grande número de moléculas impossíveis foram preparadas usando estéricos (grupos t-butil e similares, uma estratégia usada pela primeira vez há cerca de 40 anos) para evitar que a molécula reaja consigo mesma ou com outras moléculas.
- A segunda classe é uma molécula onde a ligação ou a sua estrutura são tão diferentes das teorias aceites das estruturas das moléculas que a sua energia é tão elevada que simplesmente não pode ser preparada em primeiro lugar, ou que nada pode ser feito para evitar. seu rearranjo para uma forma muito mais estável.
O primeiro dos exemplos abaixo enquadra-se claramente na primeira categoria; metano triol. Conforme relatado(cite)10.1021/jacs.4c02637(/cite), esta molécula impossível foi agora detectada tanto em baixas temperaturas quanto na fase gasosa a baixa pressão usando espectrometria de massa de tempo de voo e outros experimentos elegantes. A chave é garantir uma temperatura muito baixa ou a ausência de qualquer catalisador ácido para decompô-lo em metanol e ácido fórmico.
Como é minha prática recurring ao discutir qualquer molécula interessante, primeiro costumo realizar uma pesquisa no CSD (banco de dados de estruturas de Cambridge) – neste caso, isso deve ser dito com pouca esperança de encontrar quaisquer exemplos. Fiquei, portanto, muito surpreso ao encontrar um exemplo relatado, COLRUT.(cite)10.1021/acs.orglett.9b02161(/cite) A estrutura cristalina do COLRUT pode ser vista aqui.(cite)10.5517/ccdc.csd.cc22yztvv(/cite ) (DOI: 10.5517/ccdc.csd.cc22yztvv). Claramente, dada a discussão no topo, os alarmes deveriam soar sobre este resultado. Quando algum desses alarmes soa, minha segunda prática é recorrer aos cálculos para verificação. Neste caso, para cálculos de dados FAIR(cite)10.14469/hpc/14236(/cite) (DOI: 10.14469/hpc/14236).
O artigo(cite)10.1021/jacs.4c02637(/cite) também relata tais cálculos, mas é bom ter verificação independente (de alguns deles), então listo aqui as conclusões essenciais de meus próprios cálculos.
- No nível CCSD(T)/Def2-TZVPP, o metano triol é ΔG298 14,49 kcal/mol a mais em energia livre do que ácido fórmico e água. Esta não é realmente uma energia impossivelmente superior, e a molécula é “impossível” apenas porque há uma reação muito fácil de sofrer (desproporcionamento catalisado por ácido, por exemplo).
- No nível ωB97X-D/Def2-TZVPP muito mais rápido, o valor é 14,48 kcal/mol, o que está de acordo o suficiente com o anterior para usar este método para explorar mais.
- Se o CH for substituído por C-CF3 (novamente uma boa questão tutorial sobre como estabilizar a forma diol de, por exemplo, acetona), a energia do triol é reduzida para +9,4 kcal/mol. Ainda positivo, mas muito menor que o unique.
- Se o CH for substituído por C-(CF3)3 ainda é instável em 13,6 kcal/mol. Não há muita probability de usar substituintes para criar um triol “possível”.
- A seguir, o estado de transição para decomposição unimolecular em água e ácido fórmico. Um IRC para isso é mostrado abaixo e a energia livre de ativação é +36,6 kcal/mol. Isso procede através de uma transferência de hidrogênio muito não linear, uma geometria conhecida por ser desfavorável e, na verdade, uma energia muito alta para que esse rearranjo ocorra (em um espectrômetro de massa? Qual é a temperatura das moléculas nessas condições?). Observe como uma bela forma dos produtos com ligações de hidrogênio se forma no closing.
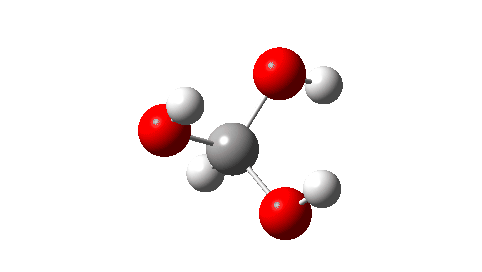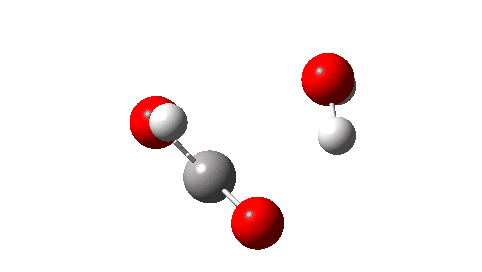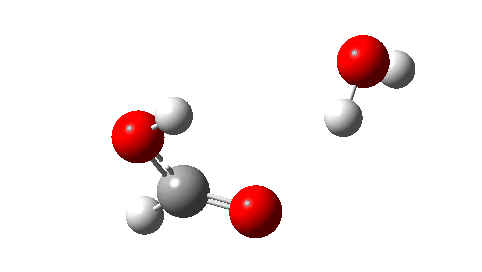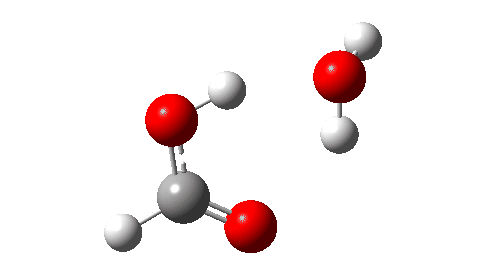
Não pude resistir em mostrar a resposta do momento dipolar ao longo do IRC. Amável! - E quanto a um rearranjo intermolecular, que ocorreria em pressões mais altas ou talvez em temperaturas mais altas? Agora, ΔG‡ = 26,7kcal/moluma reação térmica mais viável. A barreira inferior ocorre porque o estado de transição de 6 anéis agora permite uma transferência de hidrogênio menos curvada.
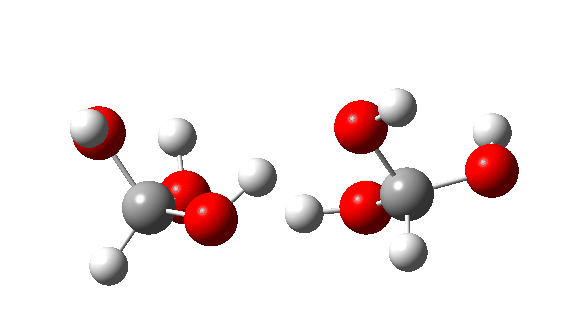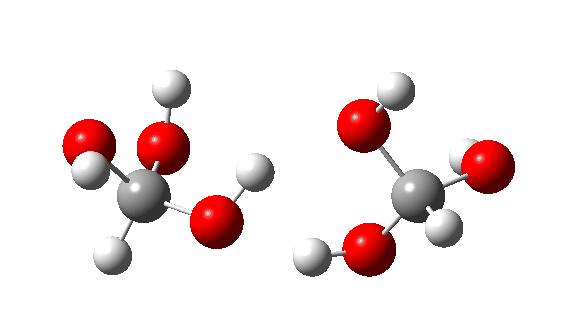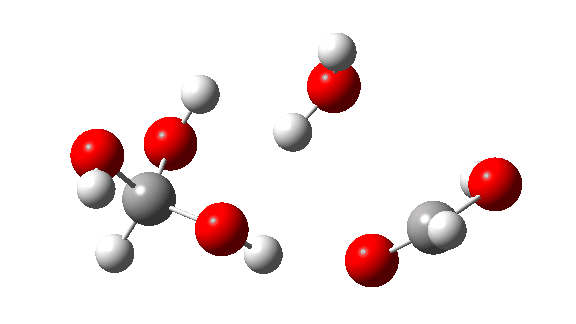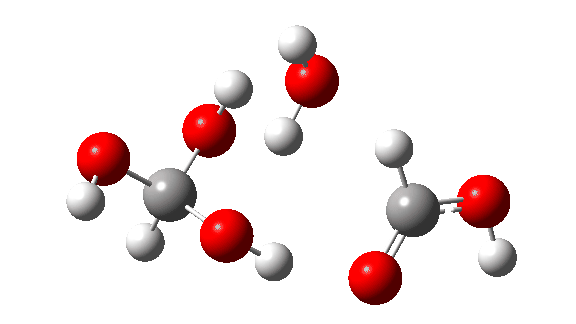
- Esta é a reação de um trímero, ΔG‡ = 24,2kcal/mol. O estado de transição de 8 anéis agora permite transferências quase lineares de hidrogênio. Observe que todos os três hidrogênios transferidos se movem mais ou menos em sincronia.
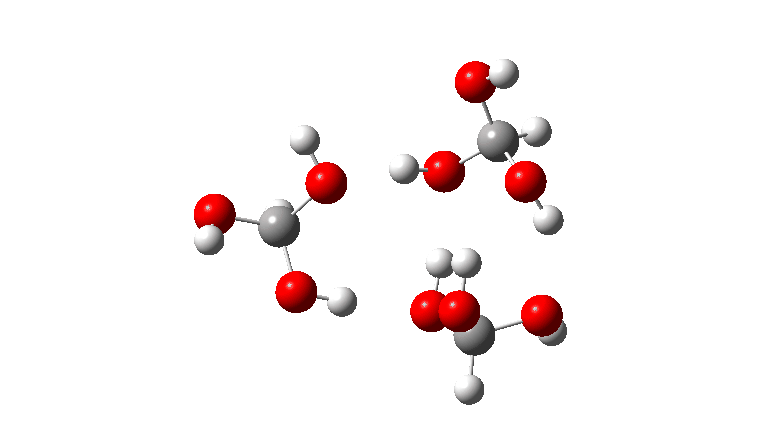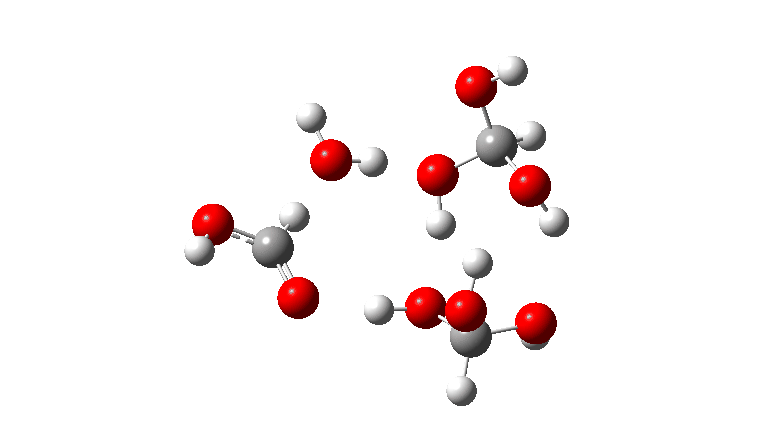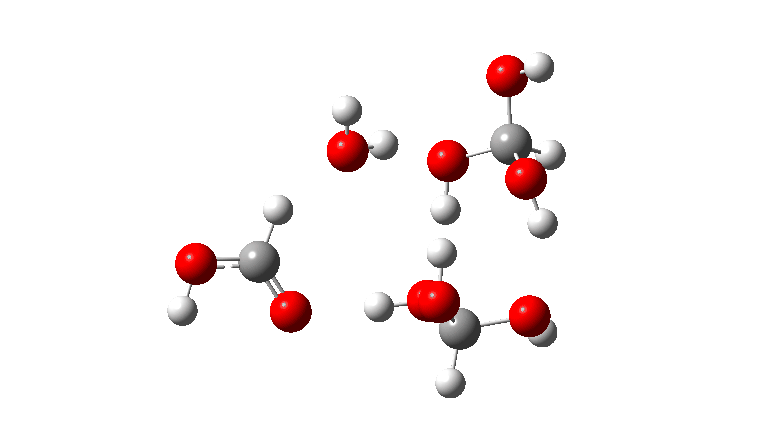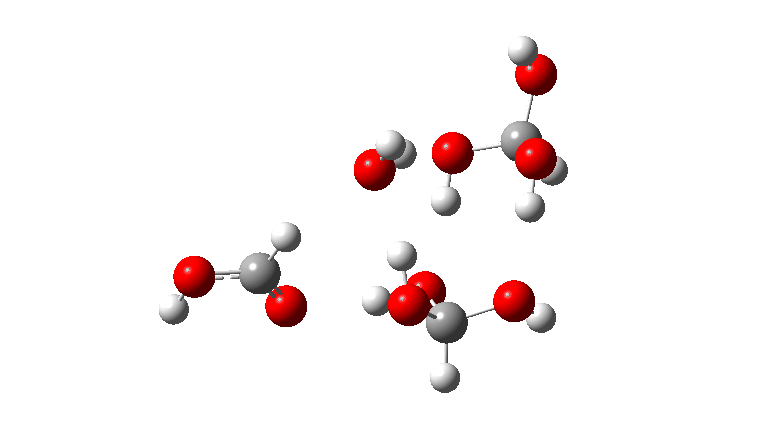
- O tetrâmero: ΔG‡ = 24,1 kcal/mol, agora através de um estado de transição de 10 anéis. Se você observar atentamente a animação, poderá ver agora que as transferências de hidrogênio se tornaram muito assíncronas (e o estado de transição mais iônico), embora permaneçam quase lineares.
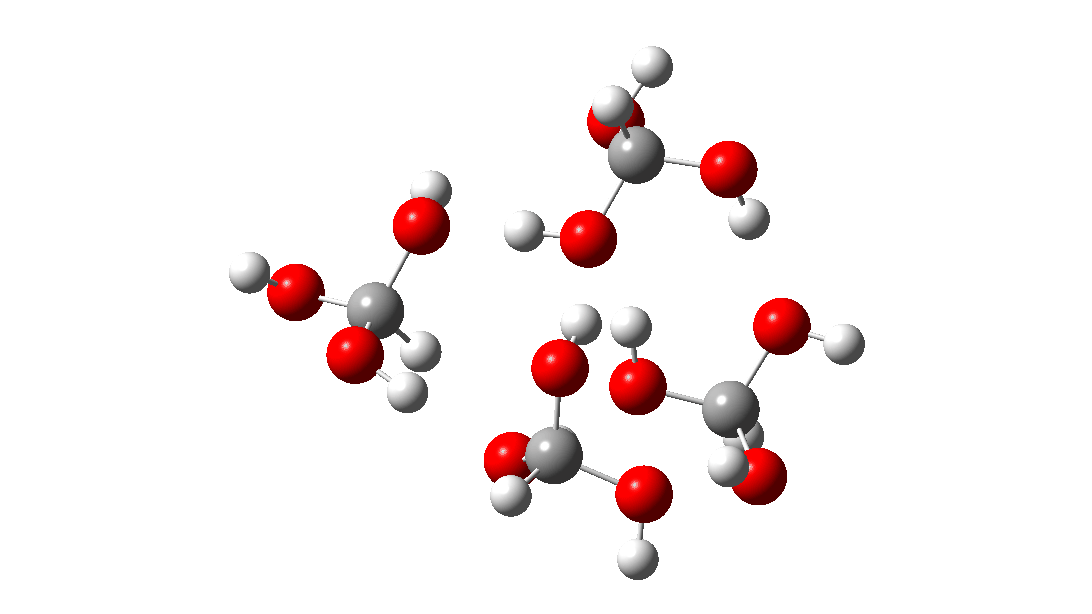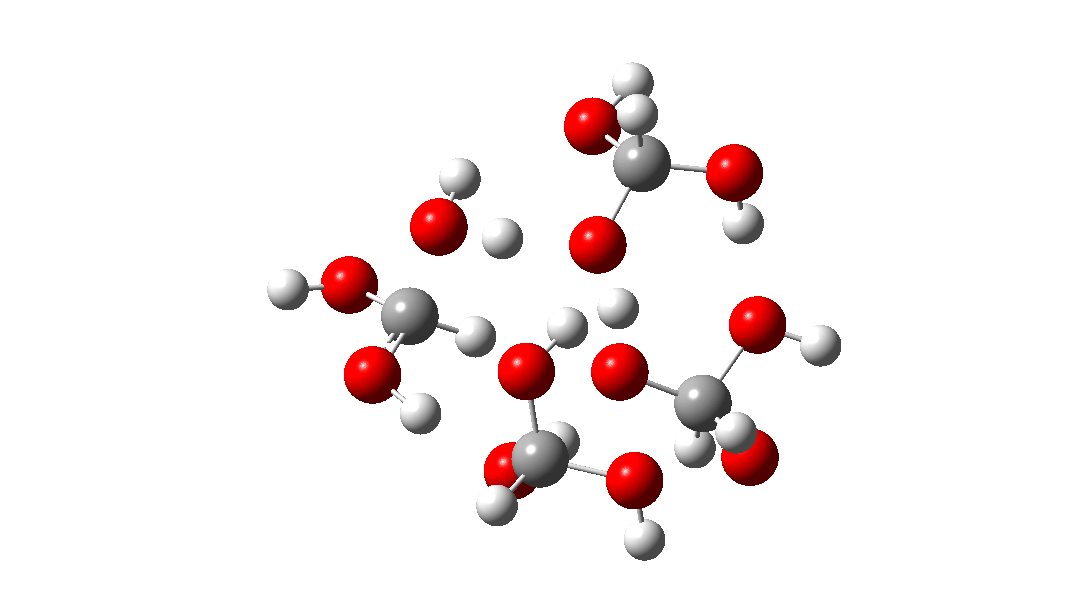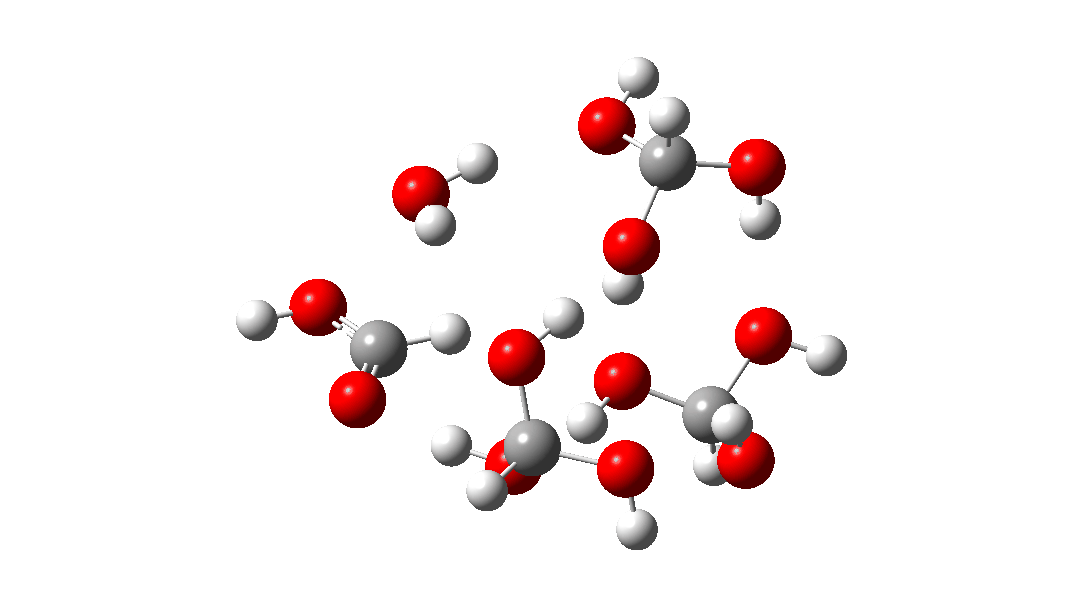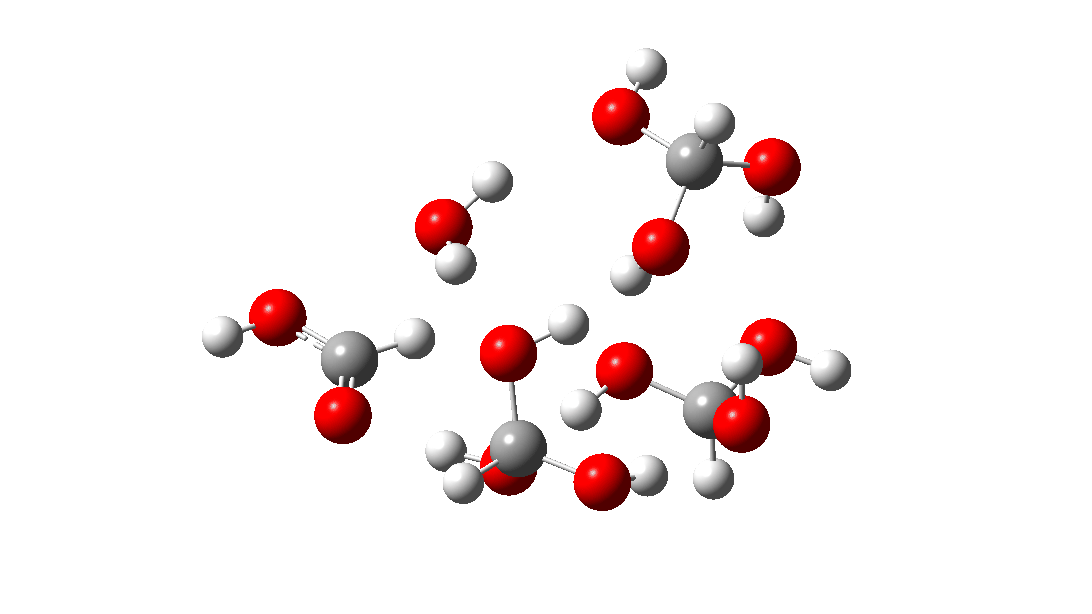
- Mas espere, há outro isômero da reação do tetrâmero, em vez disso procedendo através de um TS de 8 anéis, com a quarta molécula de triol ligando-se ao estado de transição através de quatro ligações de hidrogênio. Isto é muito parecido com um estado de transição de proteína estabilizado e supera a entropia additional de adicionar aquela quarta molécula e mais algumas; ΔG‡ = 18,9kcal/mol. Portanto, em altas concentrações, prevê-se que a desproporção do metano triol se torne uma reação fácil e agora só pode ser evitada em baixas temperaturas!
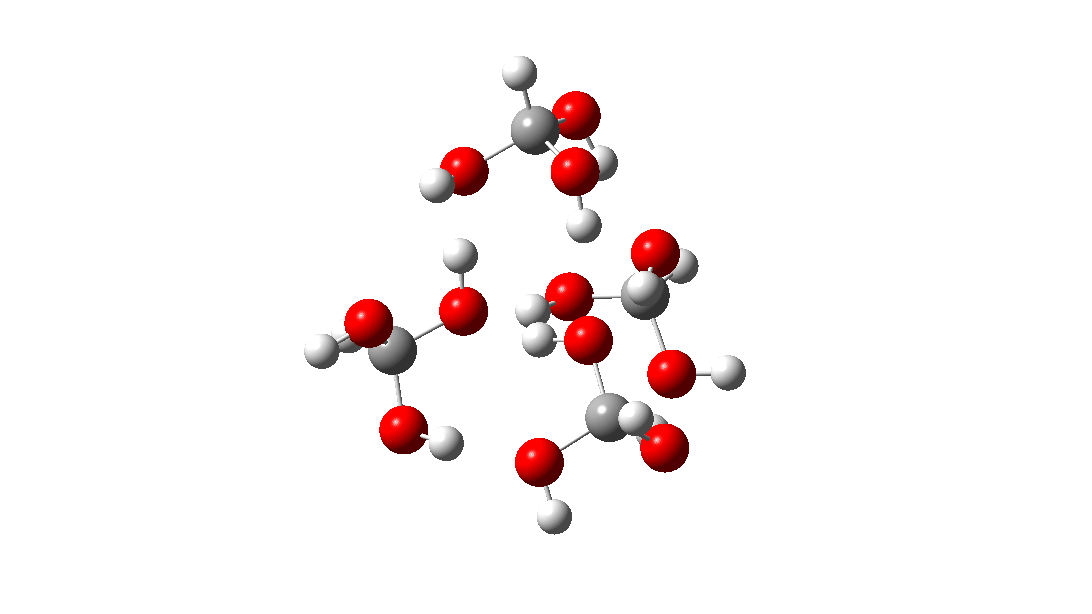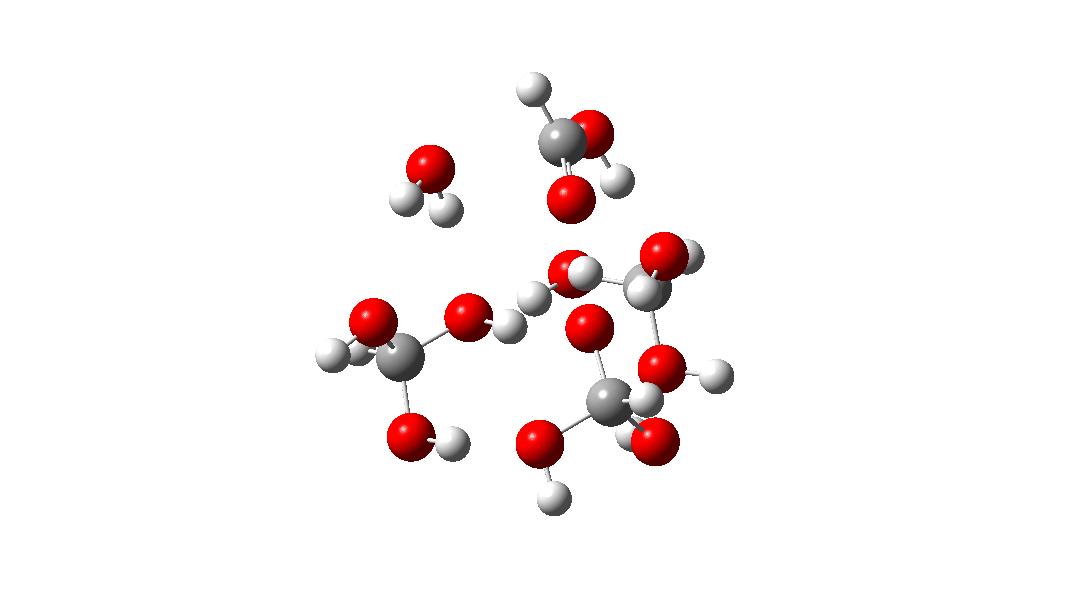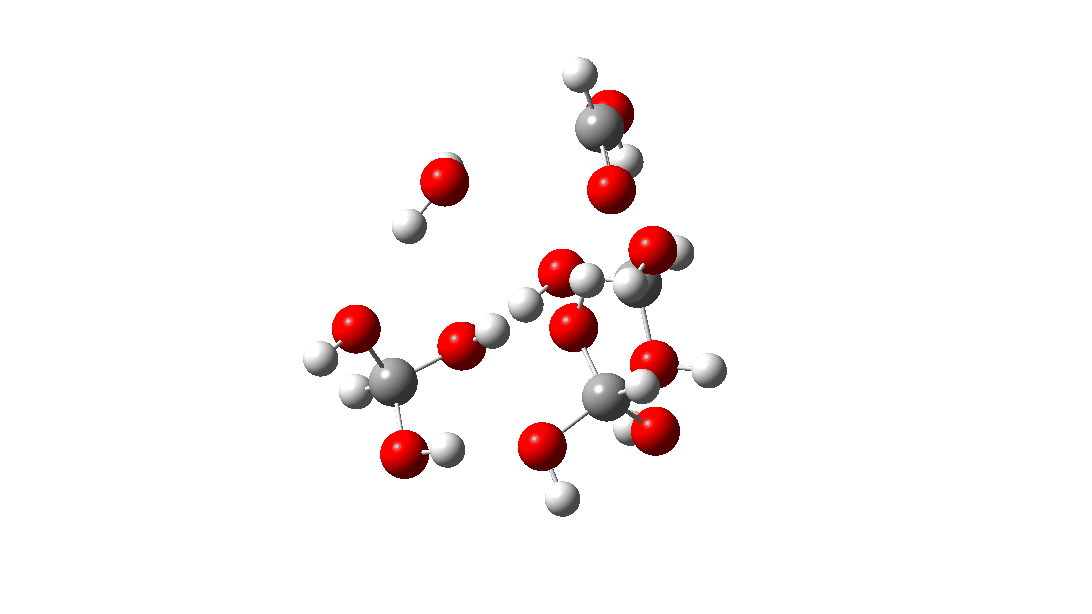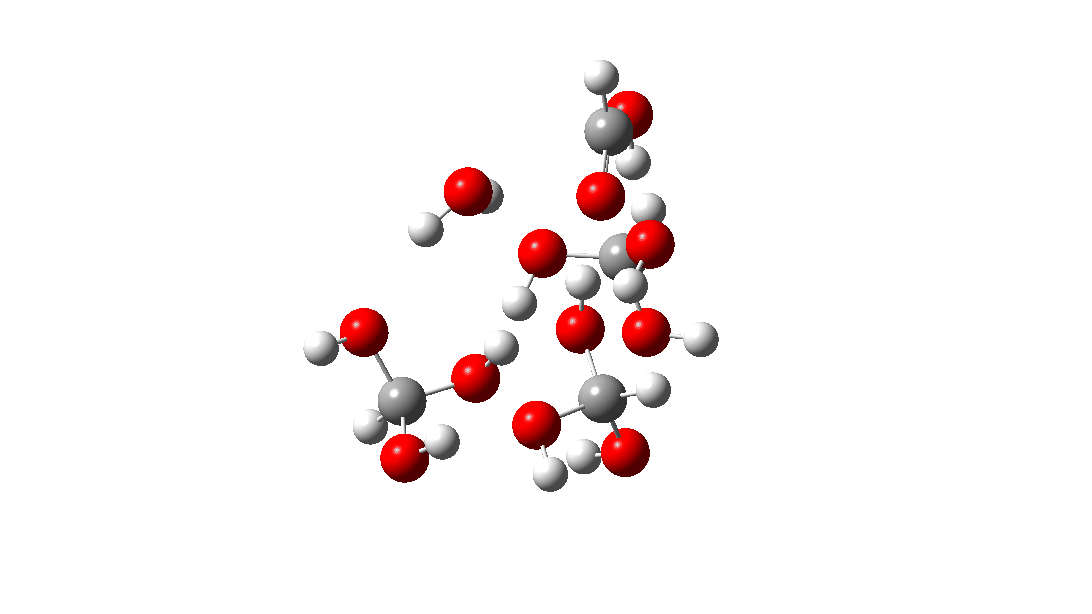
<
Uma análise NCI (interação não covalente) das ligações de hidrogênio nesta estrutura TS é mostrada abaixo. As regiões azuis são ligações de hidrogênio. As marcadas de 1 a 4 são as quatro interações resultantes da adição de uma quarta molécula à estrutura de transferência de hidrogênio do trímero. Clique para obter um modelo giratório 3D.

Portanto, espero que esta análise extensa do que torna uma “molécula impossível” realmente possível acrescente outra dimensão ao relatório unique.(cite)10.1021/jacs.4c02637(/cite) Quanto a essa estrutura cristalina, relatarei ao CCDC que ela pode na verdade, ser um artefato e que eles deveriam dar uma nova olhada nos dados da estrutura cristalina e corrigi-los, se necessário. Também é interessante explorar as propriedades das reações cíclicas de transferência de hidrogênio. A conclusão aqui é que uma transferência de 8 anéis pode ser ótima, especialmente se puder ser estabilizada com quatro ou mais ligações de hidrogênio!
Relacionado
Esta entrada foi publicada quinta-feira, 16 de maio de 2024 às 15h41 e arquivada em Sem categoria. Você pode acompanhar quaisquer respostas a esta entrada através do RSS 2.0 alimentar. Você pode deixe uma respostaou trackback do seu próprio web site.






