Pigmentos respiratórios são metaloproteínas que transportam O2sendo a mais conhecida a hemoglobina de cor vermelha brilhante/carmesim no sangue humano. A cor deriva Fé2+ no núcleo de um anel de tetraporfirina. Mas menos conhecido é sangue azule aqui a cor deriva de uma unidade de oxihemocianina baseada em Cu1+ (a forma desoxi é incolor) em vez de ferro. Veja abaixo a carapaça de um caranguejo vermelho.
Aqui dou uma olhada nesta estrutura muito incomum, cujo núcleo é um anel imidazol coordenado through nitrogênio ao steel Cu. Uma pesquisa no banco de dados de estrutura cristalina para a seguinte subestrutura
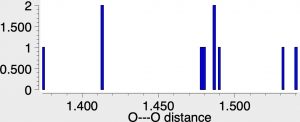
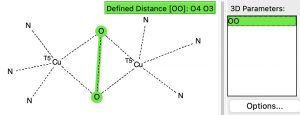 revela 12 acertos, com uma faixa de distâncias OO variando de 1,37 a 1,54Å. Um histograma dos comprimentos OO na subestrutura Cu(OO)Cu mostrado abaixo mostra uma distribuição bastante entre os 12 exemplos conhecidos.
revela 12 acertos, com uma faixa de distâncias OO variando de 1,37 a 1,54Å. Um histograma dos comprimentos OO na subestrutura Cu(OO)Cu mostrado abaixo mostra uma distribuição bastante entre os 12 exemplos conhecidos.
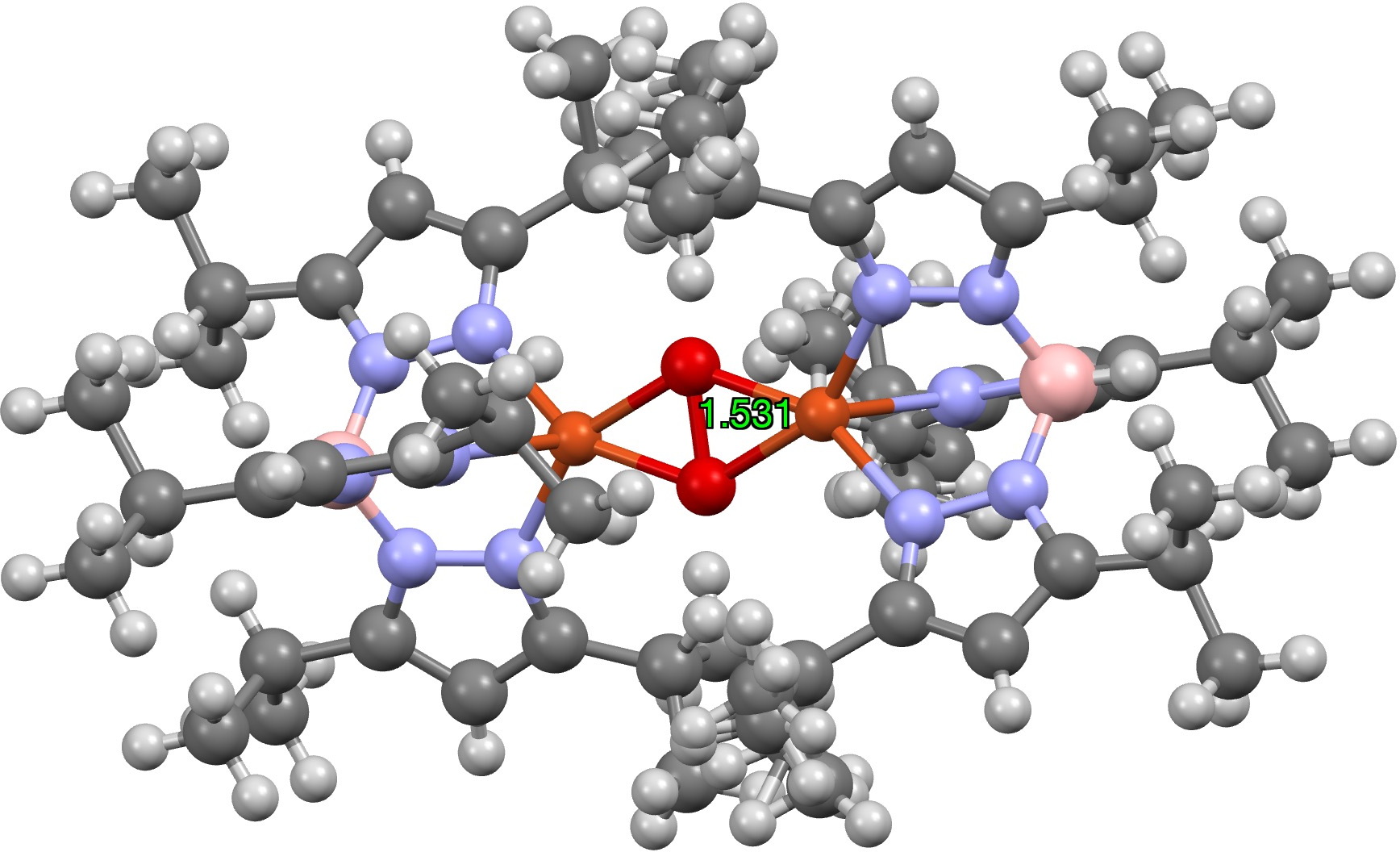
Destes, um (UTETEU(cite)10.1039/D2FD00162D(/cite), DOI: (cite)10.5517/ccdc.csd.cc1l9d7j(/cite)) é talvez o mais próximo do núcleo da oxihemocianina, embora com o heterociclo de imidazol substituído por o anel pirazol isomérico (nenhum exemplo de Ag ou Au é conhecido). O geral 2+ carga derivada de dois Cu1+ unidades é balanceada internamente com duas coordenadas B de 41- finish caps, e este sistema foi escolhido como modelo inicial para alguns estudos computacionais.(cite)10.1021/ja00030a025 (/cite)
Primeiramente, a estrutura cristalina revela uma distância OO de 1,531Å; a distância O = O (das estruturas cristalinas onde está presente) é ~ 1,24Å (DOI: 10.5517/cct597h) para oxigênio neutro (tripleto?), ~1,50Å para o dianion O22- e 1,32Å para o monoânion O21-(citar)10.1039/A800952J(/citar).
Os modelos computacionais foram construídos no nível ωB97XD/Def2-SVPP, FAIR Knowledge DOI: 10.14469/hpc/12584.
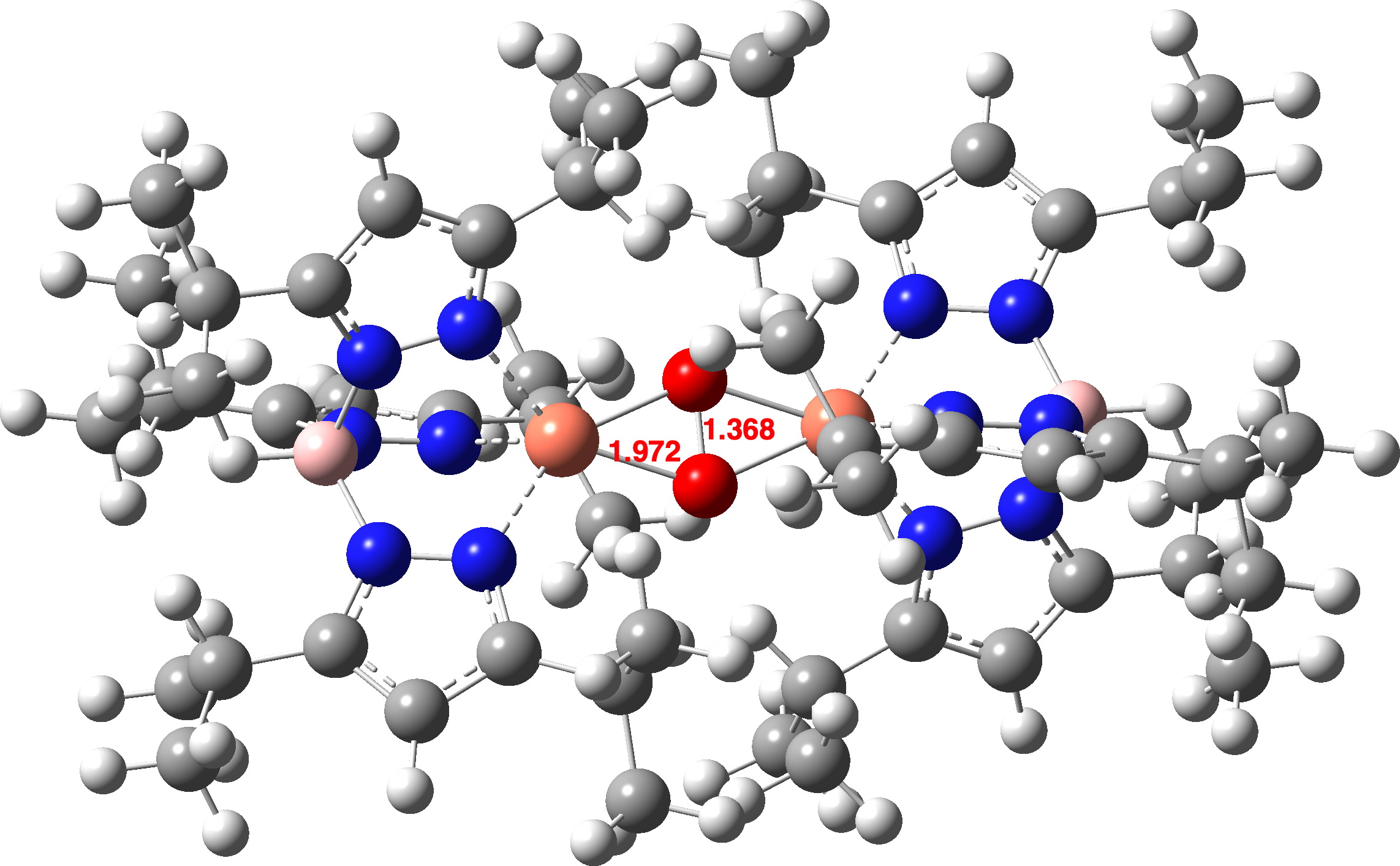
A distância OO calculada para um estado singleto do complexo é menor do que aquela medida na estrutura cristalina (1,368 vs 1,531Å). No melhor nível de conjunto de base Def2-TZVPP, o comprimento do título OO é 1,379Å, ainda mais curto. Um modelo da própria oxihemocianina no estado singleto (Def2-TZVPP) como um dication (essas cargas são equilibradas por ânions carboxilato da proteína circundante) mostra um comprimento de ligação OO muito semelhante (1,361Å).
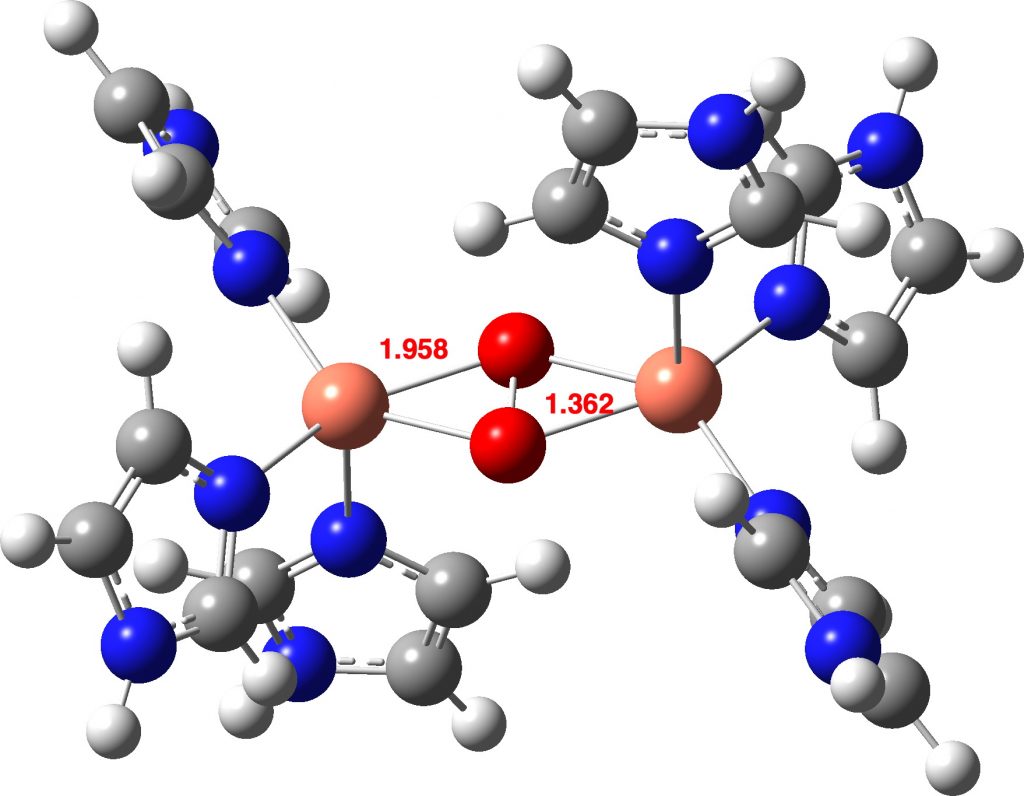
Que tal a oxihemocianina como um estado tripleto, o mesmo estado do próprio oxigênio isolado? A oxihemocianina agora tem uma distância OO de 1,477Å (Def2-TZVPP) e uma distância Cu-O de 1,972 (1,934 da estrutura cristalina de UTETEU). O análogo UTETEU tem uma distância calculada de 1,483Å (estrutura cristalina 1,531Å), o que sugere fortemente que este sistema existe como um estado de spin triplo e não como um singleto (clique na imagem abaixo para visualizar como um modelo 3D).
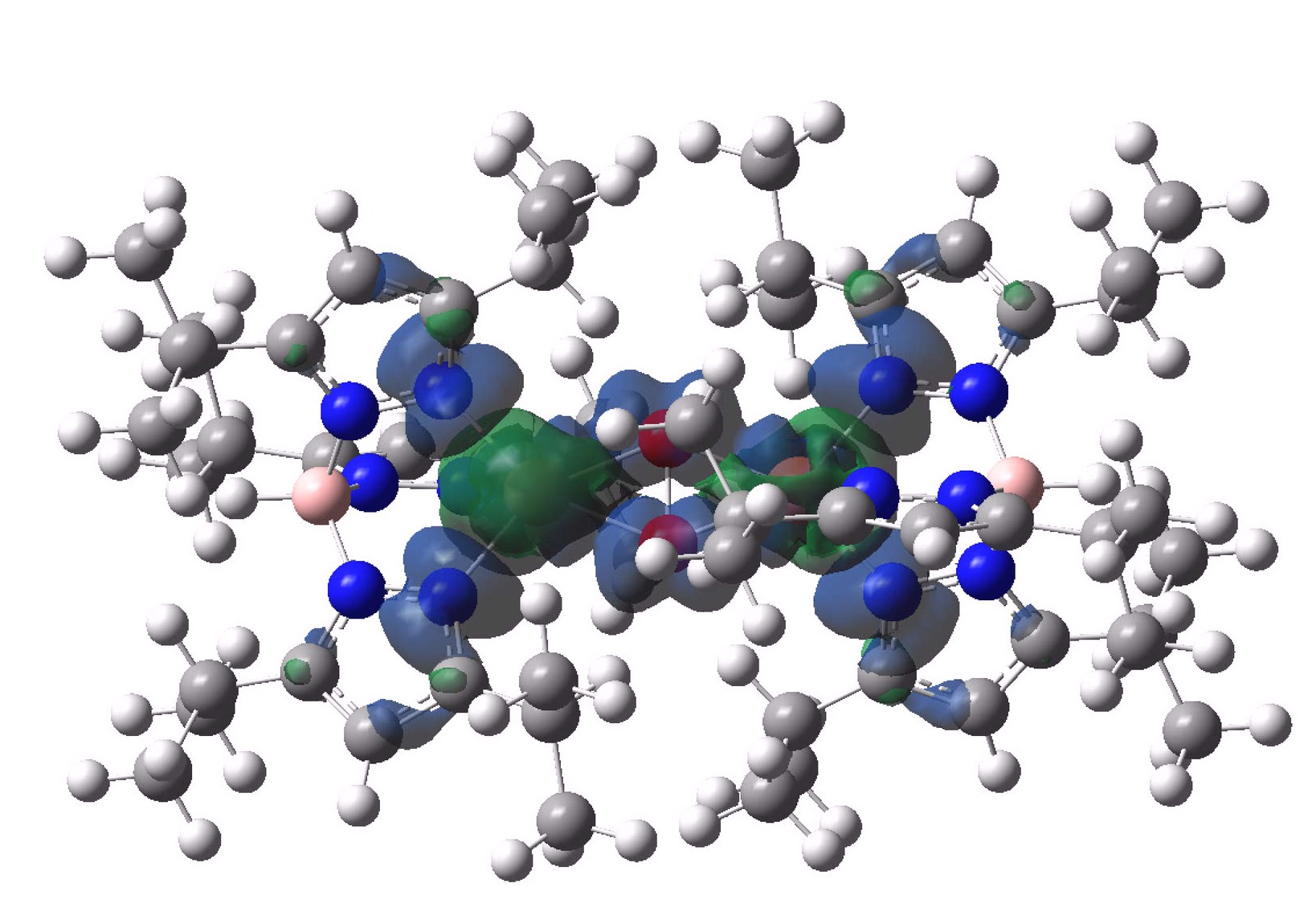
A densidade de spin em UTETEU é mostrada acima, o que indica que os dois elétrons desemparelhados estão deslocalizados em átomos de Cu, nitrogênio e O, em comparação com apenas o oxigênio em O.2 em si.
Portanto, podemos concluir desta breve investigação sobre as estruturas deste componente do “sangue azul” que captura o oxigênio como um sanduíche entre dois átomos de cobre (um modo muito diferente do equivalente de ferro na hemoglobina) e, além disso, que o estado de spin nesta captura retém o motivo triplo do próprio oxigênio gasoso, enquanto a densidade de spin dos elétrons desemparelhados é deslocalizada sobre cobre, nitrogênio e oxigênio.
Esta postagem tem DOI: 10.14469/hpc/13111
Relacionado
Etiquetas: Química interessante
Esta entrada foi publicada segunda-feira, 7 de agosto de 2023 às 11h02 e arquivada em cristal_estrutura_mineração. Você pode acompanhar quaisquer respostas a esta entrada através do RSS 2.0 alimentar. Você pode deixe uma respostaou trackback do seu próprio website.







