Estou no processo de revisar minha palestra anual para estudantes universitários do primeiro ano sobre o tema de “setas encaracoladas”. Gosto de começar minha história em 1924, quando Robert Robinson publicou o primeiro exemplo (cite) gg9g (/cite) como uma ilustração de por que o nitrosobenzeno sofre brominação eletrofílica na posição parágrafo do anel de benzeno. Eu sigo isso mostrando como a “mineração de dados” pode ser usada para ver se isso suporta sua afirmação. Eu usei a versão mais recente do banco de dados de estrutura de cristal CSD para atualizar a versão originalmente postada aqui em 2020. (cite) 10.59350/c6thp-wqe69 (/cite)
Em seguida, discuto algumas razões possíveis pelas quais Robinson pode ter pensado que a brominação entra na posição do para, incluindo a observação (citação) 10.1002/mrc.1260251118 (/cite) que o nitrosobenzeno está em equilíbrio com seu dímer, e que esse dimer pode ser esperado mais reativo a eletrófilos.
Não faz parte da palestra principal, mas mantida em reserva para qualquer dúvida no last, é a seguinte flecha encaracolada pressionando a dimerização.
Isso levanta uma pergunta simples – as setas vermelhas e azuis mostradas abaixo participam ao mesmo tempo, ou elas vão sequencialmente? Hora então para algum cálculo para responder a esta última pergunta. Um cálculo ωb97xd/def2-tzvpp/scrf = clorofórmio (citação) 10.14469/hpc/15278 (/cite) usando uma função de onda de shell fechada (para corresponder a setas de dois elétrons curly) aparece para mostrar um perfil de reação suave. O comprimento da ligação NN também converge de nenhuma ligação para uma ligação dupla brand após o estado de transição (nn = 1,3å) sem nada intermediário (este para o isômero (z)-asteroquímico, não o mostrado acima e que será discutido mais adiante). A energia livre de ativação relatada para este processo ΔG198 é 15,7 kcal/mol (cite) 10.1002/mrc.1260251118 (/cite), enquanto o valor calculado por esse método é de 25,5 kcal/mol. Mesmo permitindo um efeito de concentração (1m) e correções quase-harmônicas com a energia livre, ainda é 23,9 kcal/mol.
Em um submit anterior (citar) 10.59350/k4340-t6971 (/citar) Quando uma barreira excessivamente grande foi calculada, uma razão é que a função de onda pode ter um caráter “biradical” e que as setas encaracoladas apropriadas podem não ser a variedade de dois elétrons apropriada, mas em vez de um elétron, como mostrado abaixo.
O grau de caráter biradical é dado pelo operador de expectativa de spin 2>, que tem um valor de 0,0 para nenhum caráter biradical e 1,0 para um biradical puro. Desta vez, o estado de transição para a dimerização é calculado para ter um valor de 2> = 0,5418 e ΔG198 agora é calculado como 21,8 kcal/mol (20,3 com correções quase-harmônicas).
Os perfis de comprimento de energia e ligação de Nn para a coordenada da reação usando setas encaracoladas “um elétron” são mostradas abaixo, sendo a primeira em torno de 4 kcal/mol menor do que para as setas de dois elétrons.
O diédrico na ligação CNNC central mostra que ela quase totalmente distorcida no estado de transição (como pode ser adequado para um biradical) e, em seguida, uma rotação suave para a co-planaridade (como convém a uma ligação dupla) como a segunda ligação se forma.
Porque o sistema tem C2-Mimetria e, principalmente, nenhum plano de simetria, os elétrons π e σ agora podem se misturar e isso pode ser visto nos dois modelos de sobreposição orbital (equivalente) abaixo no estado de transição, cada par solitário de nitrogênio gerenciando para se sobrepor construcionamente (azul com roxo, vermelho com laranja, clique no diagrama para carregar os orbitals) com nnnnnnn °, n.* Orbital do segundo nitrosobenzeno.
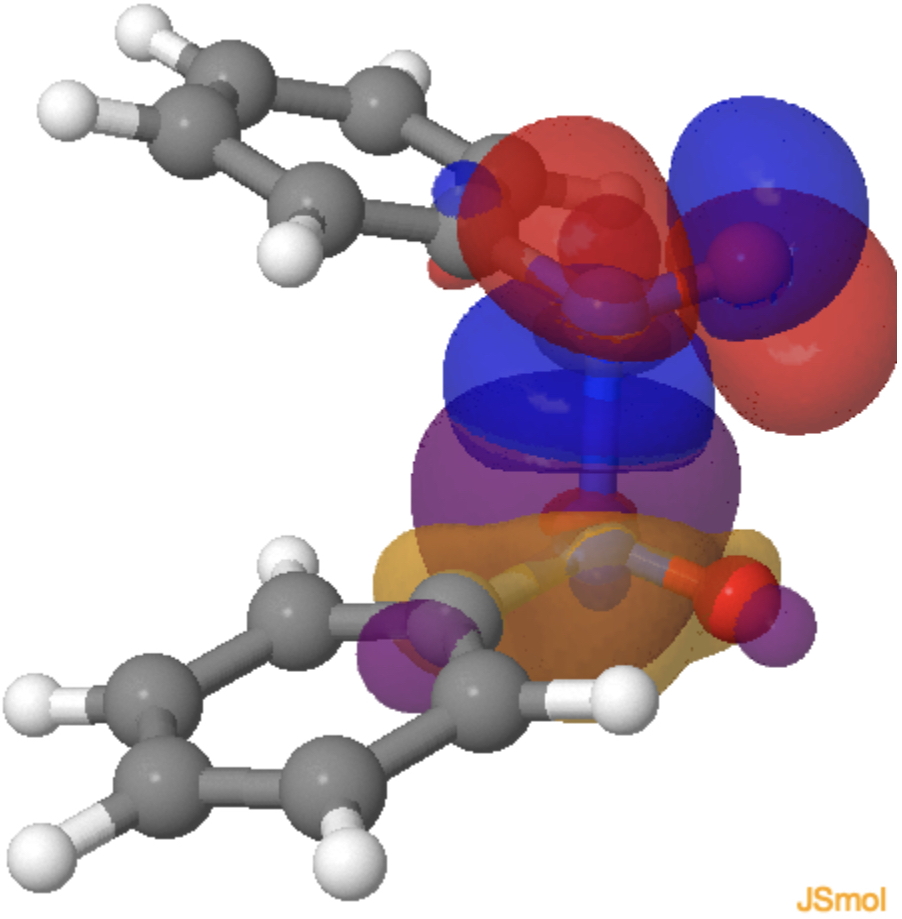
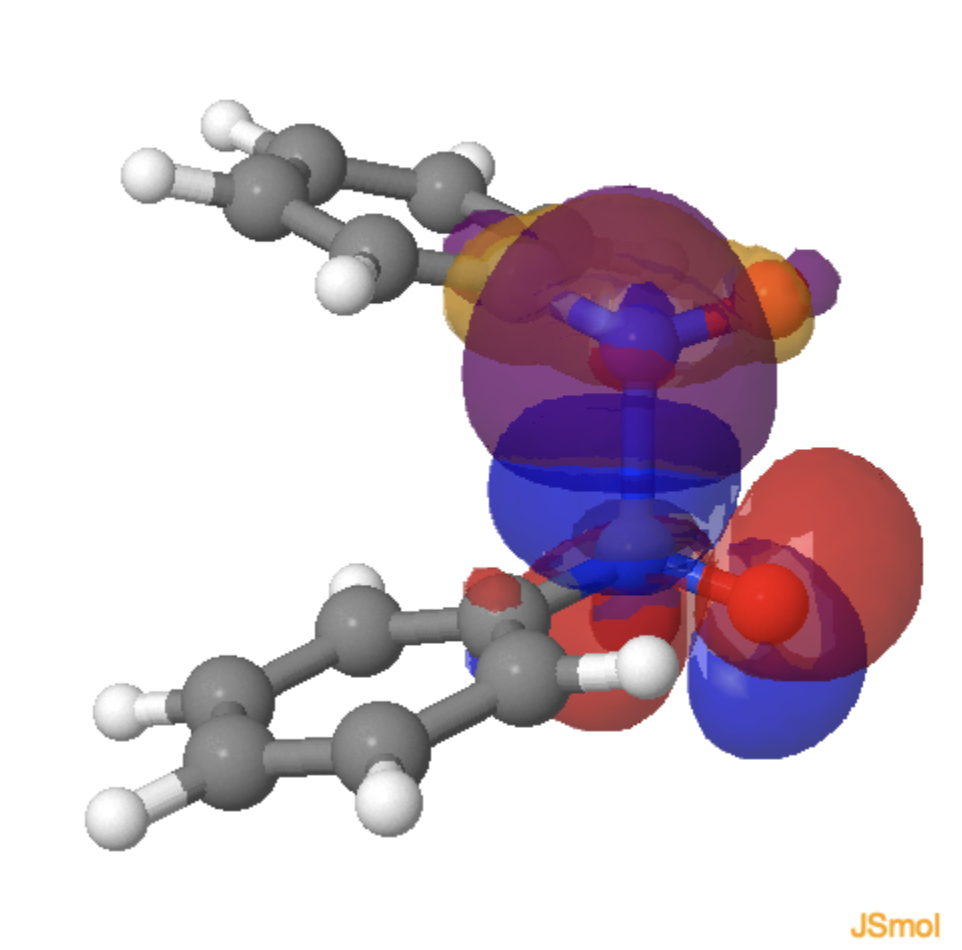
Por que esse sistema simples é melhor descrito (energeticamente) pelo uso de setas de um elétron em vez de dois elétrons? Uma explicação simples pode ser que os elétrons gostem de se mover consecutivamente simplesmente para reduzir a repulsão de elétrons que o modelo de dois elétrons imporia a ele (reduzindo a correlação de elétrons incorrida no processo). Provavelmente é mais complicado do que isso, mas mostra um exemplo raro em que setas de dois elétrons não são as mais apropriadas para descrever uma reação química.
Relacionado
Esta entrada foi publicada no sábado, 14 de junho de 2025 às 15:31 e é arquivada em Química interessante. Você pode seguir qualquer resistência a esta entrada através do RSS 2.0 alimentar. Você pode Deixe uma respostaou trackback do seu próprio website.






