Complexos de proteína-biotina. Mineração de estrutura cristalina.
No submit anteriorMostrei algumas das diversas interações “não clássicas” entre biotina e uma proteína, onde ela se liga muito fortemente. Aqui eu dou uma olhada em duas dessas interações para descobrir como elas são comuns em estruturas de pequenas moléculas.
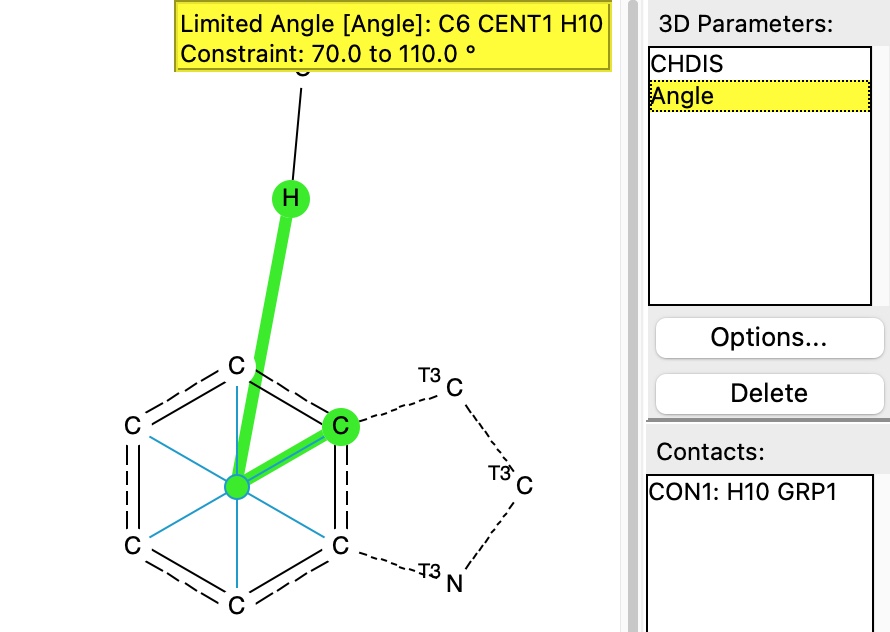
A primeira pesquisa é de uma ligação de hidrogênio CH para a face do anel aromático em um resíduo de triptofano
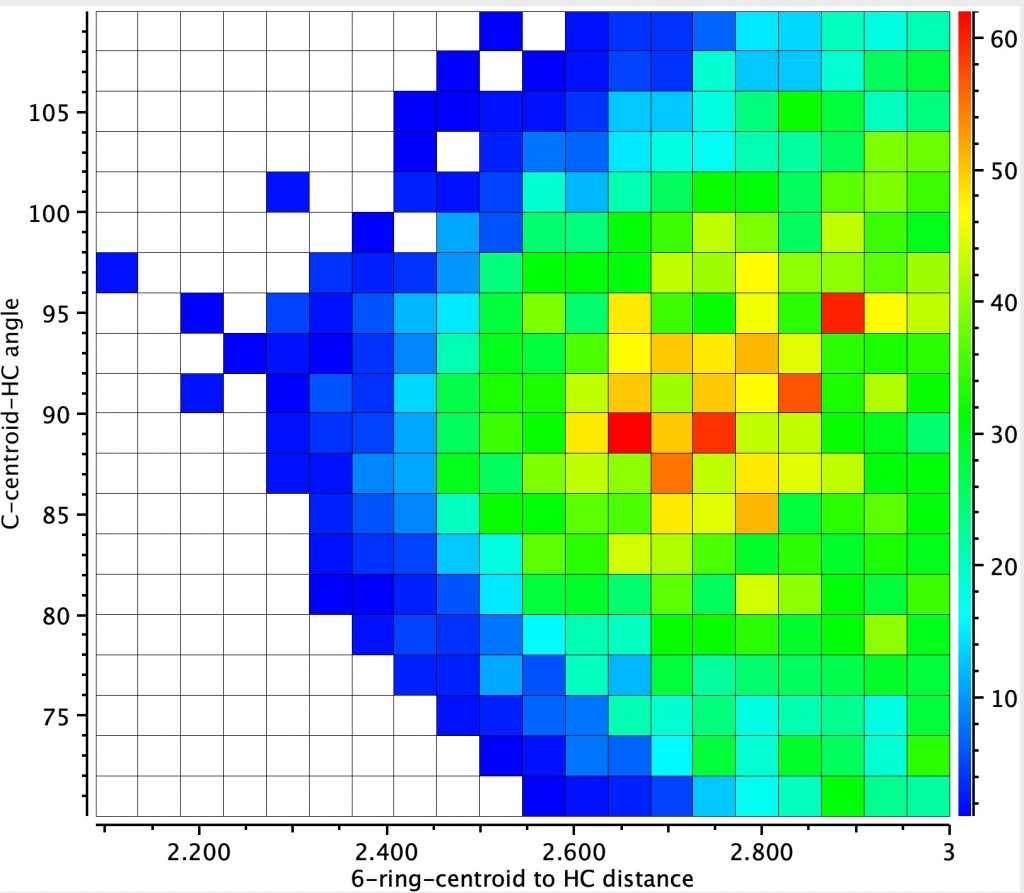
A pesquisa é mostrada abaixo, na qual a distância do hidrogênio ao centróide do anel é definida, assim como o ângulo subtendido naquele centróide, restrito a ficar dentro de 20 ° de uma abordagem vertical.
O gráfico de calor resultante mostra 2772 entradas (sem desordem, sem erros, r <0,05), com uma mancha vermelha bastante difusa em cerca de 2,7-2,8å (mas que pode ser tão curta quanto 2,3å) e um ângulo de abordagem de ~ 90 ± 5 °. Isso corresponde ao conceito de uma região de interação, em vez de uma "ligação de hidrogênio" mais focada. É visto como um motivo relativamente comum!
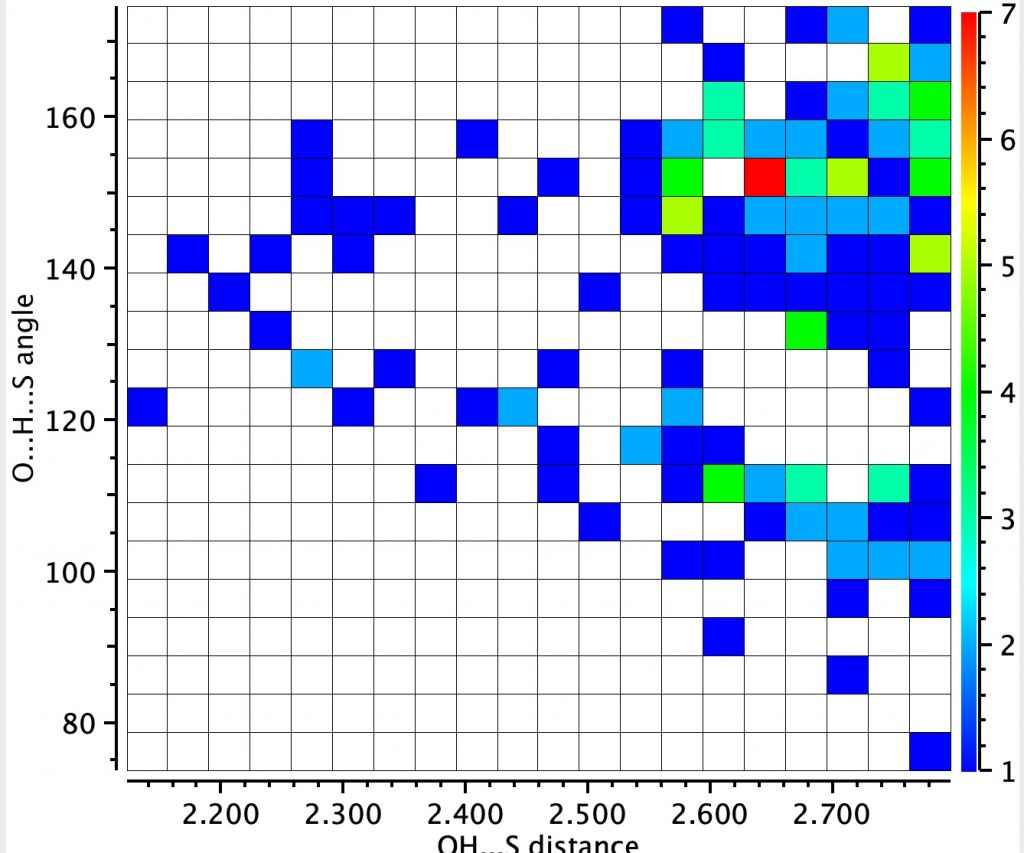
A próxima pesquisa é a “ligação de hidrogênio” entre o enxofre de uma unidade CSC (como encontrado na biotina) e um grupo OH. 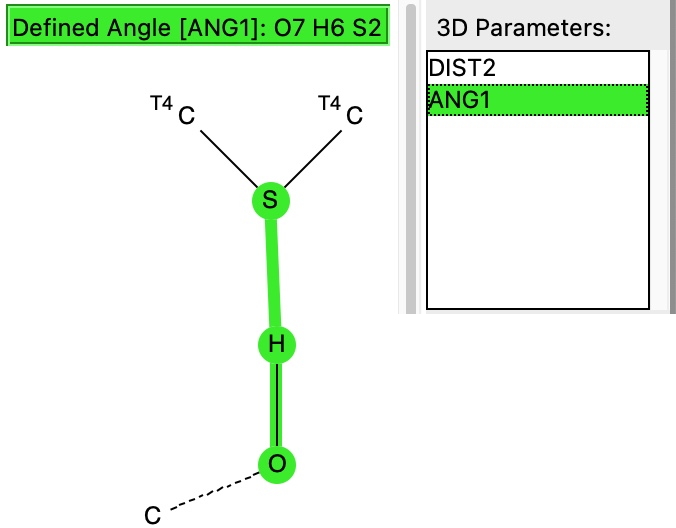
Isso é menos comum, com 151 entradas no banco de dados de moléculas pequenas de Cambridge, a mancha vermelha com uma distância relativamente curta de 1,65å e um ângulo ligeiramente não linear.
O análogo NH desta pesquisa é mostrado abaixo (422 hits) mostra dois clusters. Aquele com um grande ângulo em H é mais concentrado e revela uma distância de ~ 2,9å, enquanto o segundo cluster tem um ângulo menor e uma cauda longa para ~ 2,5å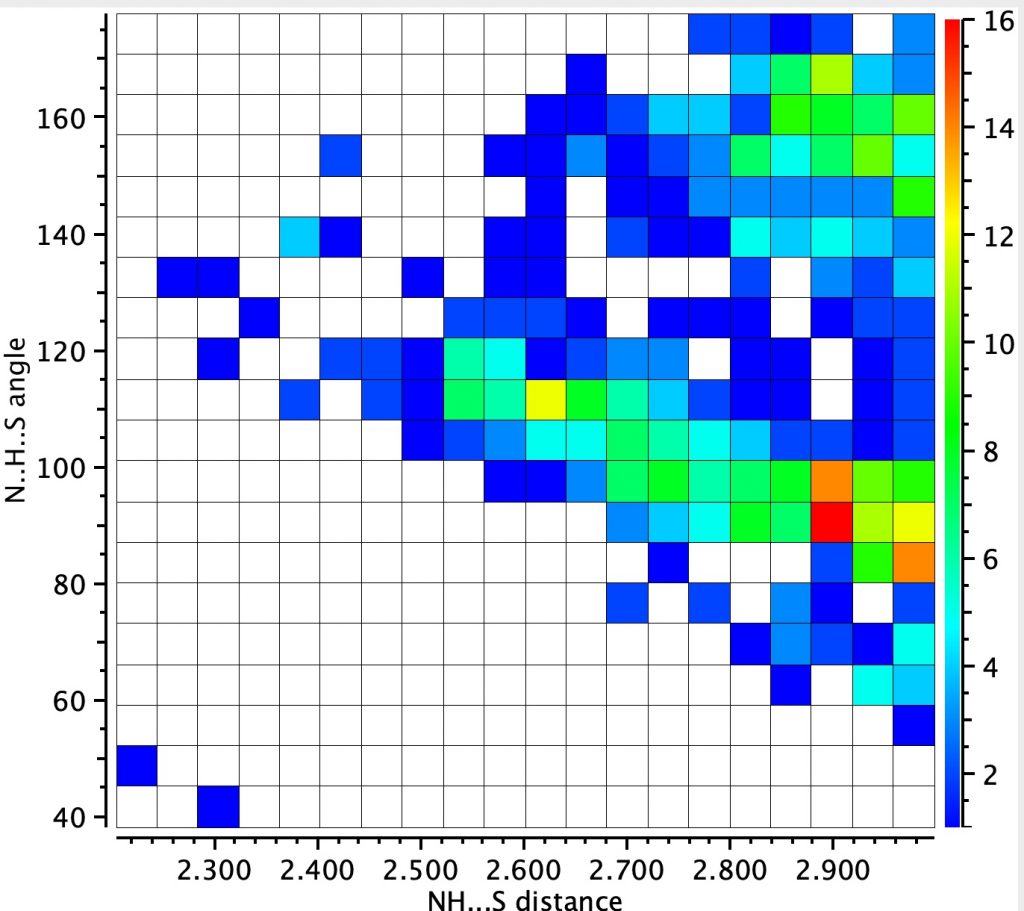
Então, concluímos que há ampla evidência em estruturas cristalinas de pequenas moléculas para os tipos de interação discutidos para biotina com proteínas.
Relacionado
Esta entrada foi publicada no domingo, 12 de dezembro de 2021 às 15:26 e é arquivada em cristal_structure_miningAssim, Química interessante. Você pode seguir qualquer resistência a esta entrada através do RSS 2.0 alimentar. Você pode Deixe uma respostaou trackback do seu próprio web site.